اسید سولفوریک
اسید سولفوریک یک اسید معدنی است که از سه عنصر گوگرد، اکسیژن و هیدروژن تشکیل شده است و به صورت مایعی بی رنگ و فاقد بو می باشد. ارزش بازار این محصول در سال 2016 بالغ بر 10 میلیارد دلار بود و پیش بینی می شود که در سال های اخیر رشد داشته باشد.
اسید سولفوریک یک اسید معدنی شناخته شده است که از 3 عنصر اکسیژن، گوگرد و هیدروژن تشکیل شده است و یک ماده اساسی در صنایع شیمیایی محسوب می شود.
این اسید در صنایع تولید کودهای شیمیایی، پالایش نفت، تصفیه فاضلاب، استخراج مواد معدنی و بسیاری از کاربردهای دیگر نقش اساسی بر عهده دارد و به همین دلیل پیش بینی شده است که بازار خرید و فروش آن در سال های آینده رشد داشته باشد.
ما در این متن قصد داریم شما را با این ترکیب اسیدی آشنا کنیم و ضمن بیان مشخصات و ویژگی های اسید سولفوریک، نگاهی به کاربردها و بازار خرید و فروش آن در دنیا بیندازیم.
اسید سولفوریک چیست؟
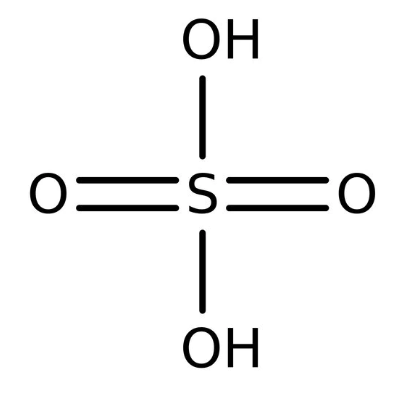
سولفوریک اسید sulfuric acid همان طور که ذکر شد یکی از اسیدهای معدنی است که در ساختار خود 2 اتم هیدروژن، 1 اتم سولفور، و 4 اتم اکسیژن دارد. (باید توجه داشته باشید که این اسید به طور کلی با اسید سولفونیک ها تفاوت دارد (علی رغم شباهت اسمی بین آنها)).
این ترکیب بسیار خورنده است و می تواند بسیاری از مواد معدنی را در خود حل کند. هم چنین یک اکسیدان شناخته شده و جزو اسیدهای قوی دسته بندی می شود.
از مشخصه های بارز آن جذب رطوبت از ترکیباتی است که با آن ها در تماس قرار می گیرد. حتی بخار آب را نیز به خود جذب می کند. به گونه ای که اگر مقداری آب را با این اسید مخلوط کنید، امکان جدا کردن این دو مایع از یکدیگر وجود نخواهد داشت.
به دلیل همین ویژگی ها در صورتی که اسید سولفوریک با پوست انسان تماس پیدا کند، باعث سوختگی شدید خواهد شد (این ترکیب در عین حال که اقدام به جذب رطوبت از پوست می کند، به دلیل تولید گرمای زیاد، باعث سوختگی پوست بدن انسان خواهد شد).
به همین دلیل است که کوچک ترین مقدار از این اسید می تواند بسیار خطرناک باشد. البته در صورتی که آن را در آب حل کنید، به دلیل کاهش غلظت می تواند خطرات کمتری را در پی داشته باشد. زیرا که خاصیت اکسیدکنندگی و جاذب بودن این اسید در غلظت های بالا بسیار بیشتر است.
اهمیت تجاری اسید سولفوریک
سولفونیک اسید را یک محصول تجاری بسیار مهم می دانند که در بسیاری از فرایندهای شیمیایی و صنعتی نقش اساسی بازی می کند. این امر به دلیل ویژگی های منحصر به فرد این اسید است که در بالا به تعدادی از آن ها اشاره شد. حجم تولید این اسید در هر کشور نشانه ای از میزان رشد و پیشرفت صنعتی آن کشور محسوب می شود.
با توجه به گستردگی نیاز صنعت به این ترکیب، روش های متعددی برای تولید آن استفاده می شود که هر یک در فرایندهای متفاوتی باعث تولید این محصول در مقیاس تجاری خواهند شد.
اگر چه می توان این اسید را به طور خالص نیز تولید کرد، اما گریدهای تجاری به طور معمول دارای غلظت کمتری هستند. در مقیاس تجاری گرید 98.3 و 93.2 درصد بالاترین غلظت ها را دارند. اما در گرید پایین تر می توان غلظت های بین 78 تا 80 درصد و نیز 62 تا 70 درصد را نیز برای خرید در بازار یافت.
غلظت های کمتر را در گریدهای حدود 30 درصد و کمتر از 30 درصد نیز می توان در بازار برای خرید پیدا کرد که در واقع اسید رقیق شده هستند.
بر اساس براوردها، ارزش بازار خرید و فروش اسید سولفوریک در سال 2016 برابر با 10.1 میلیارد دلار بر اورد شده بود و به دلیل نیاز بیشتر به تولید کودهای شیمیایی و فسفات ها پیش بینی می شود که ارزش این بازار رشد قابل توجهی در سال های آینده تجربه کند.
مشخصات فیزیکی و شیمیایی اسید سولفوریک
| فرمول مولکولی | H2SO4 |
| جرم مولی | 98/078 g/mol |
| شکل ظاهری | مایع شفاف، بیرنگ و بیبو |
| چگالی | 1.84 g cm-3 liquid |
| دمای ذوب | ۱۰°C |
| دمای جوش | ۲۹۰°C |
| انحلالپذیری در آب | حلپذیری کامل (گرماده) انتالپی منفی |
| گرانروی | 26.7 cP at 20 °C |
 |
 |
این اسید دارای فرمول شیمیایی H2SO4 می باشد و در صورت خالص بودن به صورت مایعی بی رنگ و شفاف به نظر خواهد رسید. از جنبه ظاهری شبیه به روغن و ویسکوز است و برای همین به آن نام روغن ویتریول را داده اند.
این اسید فاقد بو بوده و بر خلاف بسیاری از اسیدهای دیگر که از بوی آن ها قابل تشخیص می باشند، از بوی آن قابل تشخیص نخواهد بود.
چگالی این اسید حدود 1.8 گرم بر سانتی متر مکعب می باشد و در دمای حدود 10 درجه سانتی گراد (حدود 50 درجه فارنهایت) ذوب خواهد شد.
نقطه جوش آن نیز برابر با 337 درجه سانتی گراد (639 درجه فارنهایت) است. البته باید توجه داشته باشید که این اسید با افزایش دما (و در دماهای بالای 300 درجه سانتی گراد)، قبل از این که به جوش بیاید تجزیه می شود.
اسید سولفوریک همان طور که گفته شد در آب حل می شود و این واکنش برگشت پذیر نخواهد بود. حل شدن سولفوریک اسید در آب منجر به تولید هیدرات ها می شود.
نکته دیگر این است که این اسید در مقیاس تجاری 100 درصد خالص نیست و برای همین به طور معمول شفاف نبوده و دارای رنگ است که این رنگ با توجه به غلظت آن متفاوت خواهد بود.
سولفوریک اسید خالص که با آب مخلوط نشده است به شدت قطبی است و دارای ضریب دی الکتریک نزدیک به 100 است و برای همین (بر خلاف ویسکوز بودن و شباهت خود به روغن)، یک رسانای جریان الکتریکی بسیار قوی محسوب می شود.

واکنش های اسید سولفوریک
به دلیل این که سولفوریک اسید به سرعت در آب حل و تولید گرما می کند، باید همواره به جای این که آب را به اسید اضافه کنید (در صورت نیاز به رقیق کردن این محصول)، اسید را به تدریج به آب اضافه کنید تا مشکلی به وجود نیاید.
نکته دیگر در مورد واکنش پذیری این ترکیب این که سولفوریک اسید به دلیل جاذب بود خود، می تواند مولکول های آب را از ترکیبات شیمیایی دیگر جدا و حذف کند. برای مثال این اسید با قرار گرفتن در معرض شکر و یا کربوهیدارات ها باعث تولید کربن، گرما و بخار آب خواهد شد.
در آزمایشگاه این کار با ریختن شکر در اسید سولفوریک به نمایش در خواهد آمد که در پی آن رنگ سفید شکر به رنگ قهوه ای یا تیره در خواهد آمد و مولکول های آب جدا شده از کربوهیدرات ها به صورت بخار آزاد خواهند شد.
نه تنها شکر و قند، که نشاسته نیز پس از تماس با این اسید تجزیه شده و به اتم های کربن و مولکول های آب تبدیل می شود. اگر شما کمی از این اسید را بر روی کاغذ که دارای ترکیبات سلولزی است بریزید، به خوبی شاهد این فرایند خواهید بود.
واکنش اسید سولفوریک با فلزات و ترکیبات معدنی
این اسید می تواند آب را از ترکیبات معدنی که دارای مولکول آب هستند جدا کند. به عنوان مثال واکنش سولفات مس هیدراته می تواند به دلیل جدا شدن مولکول های آب، سولفات مس فاقد آب را به همراه داشته باشد.
در این واکنش پس از قرار گرفتن سولفات مس دو در تماس با اسید سولفوریک شما شاهد تغییر رنگ آن از آبی به رنگ سفید خواهید بود. تغییر رنگ کریستال های این سولفات به دلیل حذف مولکول اب از ساختار آن ها می باشد که سولفات مس هیدراته را به سولفات مس فاقد آب تبدیل خواهد کرد.
علاوه بر این، سولفوریک اسید حتی در حالتی که رقیق شده باشد با بسیاری از فلزات واکنش نشان خواهد داد. برای مثال اگر عنصر آهن را در معرض اسید سولفوریک قرار دهید، شاهد تولید هیدروژن و سولفات آهن خواهید بود.
این اسید به فلزات غیر فعال نیز حمله خواهد کرد و باعث تشکیل سولفات فلزات خواهد گردید. آهن، آلومینیوم، منیزیوم و منگنز از جمله فلزاتی هستند که با این اسید واکنش می دهند. هم چنین مس، نیکل و روی نیز به طور مشابهی با این ترکیب اسیدی واکنش می دهند.
در غلظت های بالا نیز به عنوان یک عامل اکسید کننده فلزات شناخته می شود. البته سرب و تنگستن در برابر این اسید از خود مقاومت نشان می دهند و به راحتی واکنش نمی دهند.
تولید اسید سولفوریک
سولفوریک اسید را به طور تجاری از روش های مختلفی به دست می اورند. یکی از این روش ها پروسه تماس DCDA می باشد که با استفاده از سولفور، اکسیژن و هیدروژن در چند مرحله انجام می شود.
در مرحله اول سولفور یا اتم گوگرد را می سوزانند تا دی اکسید گوگرد تولید شود. پس از آن دی اکسید گوگرد را اکسید می کنند تا به تری اکسید گوگرد تبدیل شود (در این مرحله نیاز به استفاده از کاتالیست می باشد که به طور معمول از اکسید وانادیوم استفاده می شود).
پس از آن تری اکسید گوگرد را جذب سولفوریک اسید می کنند تا ترکیب جدیدی با نام اولئوم تشکیل شود. اولئوم را با نام اسید سولفوریک فومینگ نیز می شناسند و پس از رقیق شدن با آب به اسید سولفوریک با غلظت مدنظر تبدیل خواهد شد.
البته فرایندهای دیگری هم هستند که در مقیاس تجاری برای تولید این ترکیب اسیدی استفاده می شوند. که هر یک سهمی از تقاضای بازار برای این محصول را تامین می کنند. ما در ادامه نگاهی به کاربردها و بازار خرید و فروش این محصول خواهیم نمود.
کاربردهای اسید سولفوریک
حجم تولید اسید سولفوریک در یک کشور دلیلی برای میزان پیشرفت آن کشور در بخش صنعت خواهد بود. زیرا که این ترکیب یکی از اساسی ترین ترکیباتی است که در بسیاری از صنایع تولیدی مورد استفاده قرار می گیرد.
بیشتر اسید سولفوریک تولید شده در دنیا به مصرف تولید کودهای شیمیایی می رسد که نقش اساسی در تولید محصولات کشاورزی بازی می کنند. به خصوص کودهای فسفات دار مانند امونیوم فسفات و امونیوم سولفات که از مهم ترین آن ها هستند.
کاربرد دیگر این اسید در تولید مواد شوینده می باشد. در کنار این در صنعت پالایش نفت نیز از آن به عنوان کاتالیست استفاده می شود. هم چنین در صنایع پتروشیمی و شیمیایی کاربرد دارد و به خصوص در تولید نایلون ها این کاربرد اهمیت بسیار بیشتری پیدا خواهد کرد.
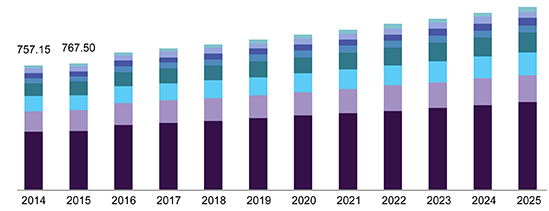
در تولید حشره کشها و نیز در تولید الومینیوم از این ترکیب استفاده می شود. در صنایع تولید باتری (باتری های lead-acid) از این اسید به عنوان الکترولیت استفاده می شود. ، تولید روان کننده ها یا لوبریکانت ها، صنعت نساجی و بسیاری از صنایع دیگر نیز هر یک نیاز خاص خود را به این ترکیب در فرایندهای تولیدی دارند. نمودار بالا رشد تقاضا را بازار خرید و فروش این محصول در ایالات متحده نشان می دهد.
خرید و فروش اسید سولفوریک
در سال 2004 حدود 180 میلیون تن سولفوریک اسید در دنیا تولید شد که از این میزان 35 درصد در آسیا تولید شده بود. پس از آسیا، آمریکای شمالی بیشترین سهم تولید سولفوریک اسید را به خود اختصاص داده بود که حدود یک چهارم تولید جهانی این محصول بود.
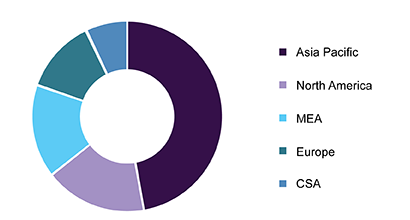
اما در سال های اخیر سهم آسیا از این بازار بیشتر از سال 2004 شده است. به گونه ای که در سال 2016 سهم آسیا از این بازار به 46 درصد رسید و به دلیل افزایش تولید این محصول به نظر می رسد که در سال های آینده آسیا نقش موثرتری در این بازار داشته باشد.
در آسیا چین از صادرکننده های این ترکیب اسیدی محسوب می شود که به نظر می رسد افزایش صادرات این محصول از چین به کشورهای دیگر آسیایی مانند هند و فیلیپین نقش موثری بر رشد بازار منطقه ای خرید و فروش اسید سولفوریک داشته باشد.
شما در نمودار بالا می توانید سهم هر یک از بازارهای منطقه ای را از بازار خرید و فروش این محصول را در سال 2016 مشاهده کنید.
نکته مهم این که قیمت اسید سولفوریک در بازارهای آسیایی به دلیل افزایش تقاضا برای آن نسبت به سال های قبل بیشتر شده است. به خصوص نیاز بیشتر به کودهای فسفات دار از عوامل موثر بر افزایش قیمت اسید سولفوریک بوده است.